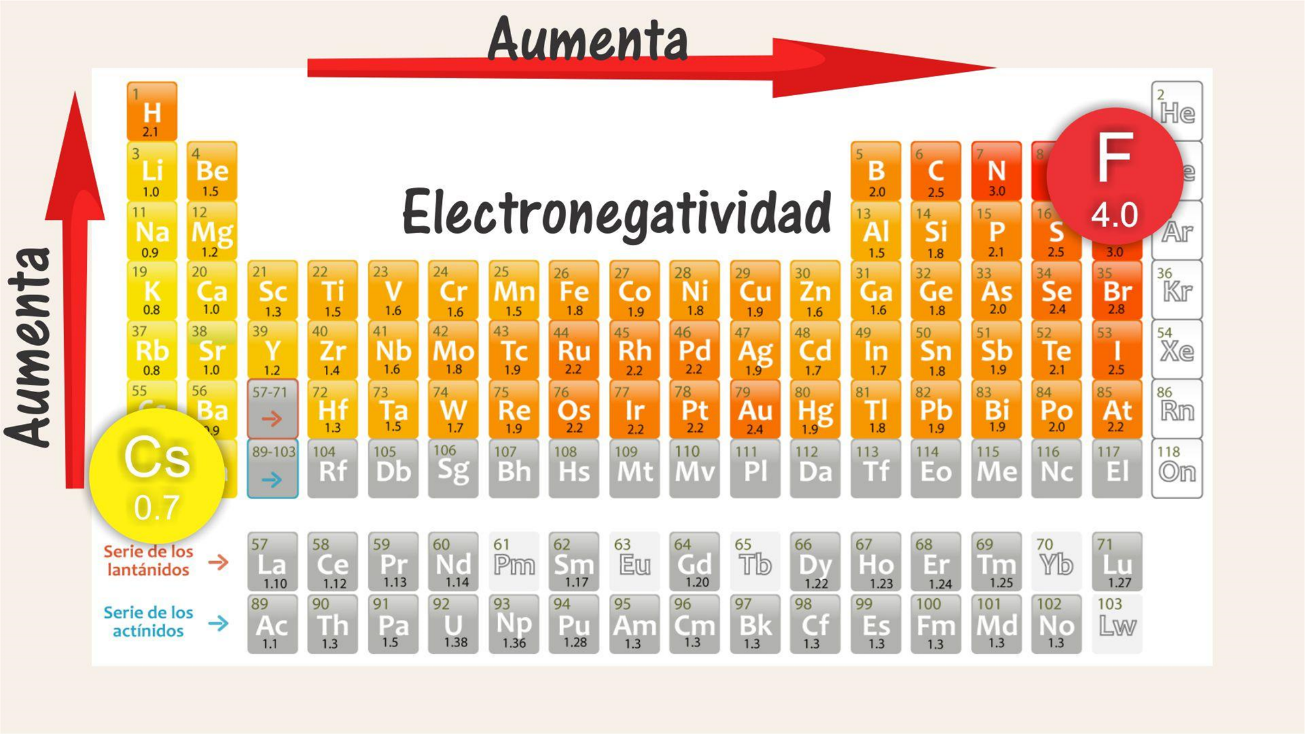
Electronegatividad
Definiciones
Sección titulada «Definiciones»- Electronegatividad: Es la capacidad de un átomo para atraer hacia sí los electrones en un enlace químico.
- Radio atómico: Es la distancia que existe desde el núcleo de un átomo hasta el electrón más externo.
- Enlace químico: Es la fuerza que mantiene unidos a los átomos dentro de una molécula.
- Geometría molecular: Es la forma tridimensional que adoptan las moléculas en el espacio, determinada por la repulsión de los pares de electrones.
Propiedades periódicas
Sección titulada «Propiedades periódicas»La tabla periódica organiza los elementos según sus propiedades, las cuales se repiten periódicamente. Algunas de las propiedades más importantes:
- Carácter metálico: Se refiere a si un elemento se comporta como metal (tendencia a ceder electrones, propiedades como conductividad, brillo) o no metal (tendencia a ganar electrones).
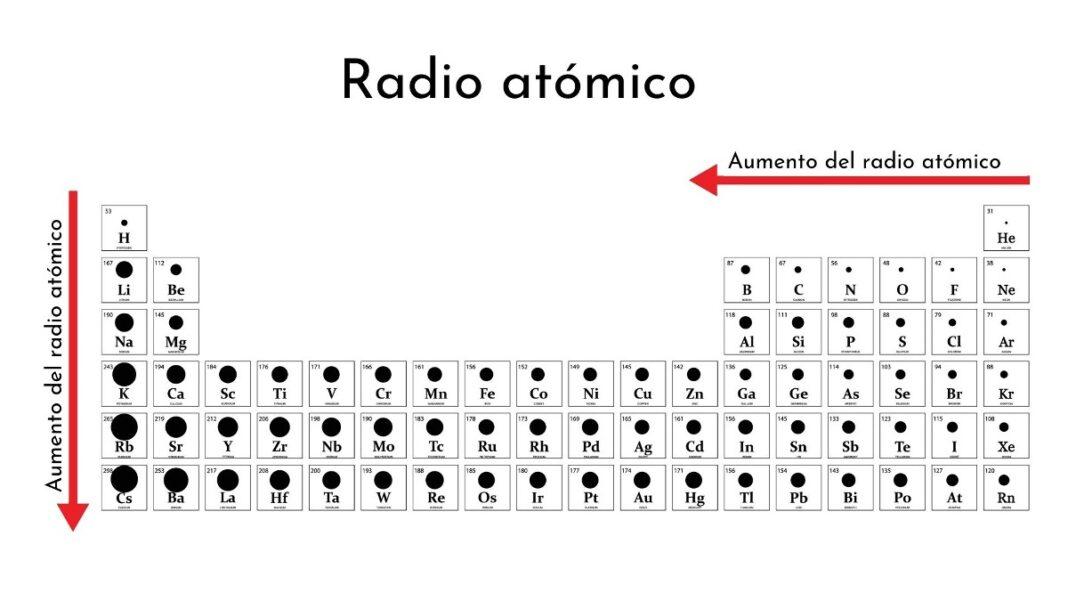
- Radio atómico: Es el tamaño de un átomo. Generalmente, el radio atómico aumenta a medida que se desciende en un grupo y disminuye a medida que se avanza en un período.
- Electronegatividad: Los no metales suelen tener mayor electronegatividad que los metales.
Los átomos tienden a ganar, perder o compartir electrones para alcanzar una configuración de ocho electrones en su capa de valencia (regla del octeto), similar a los gases nobles, lo que les confiere estabilidad. Para simplificar la configuración electrónica se usa la notación de Kernet: una forma abreviada de escribir la configuración electrónica de un elemento utilizando el símbolo del gas noble anterior en la tabla periódica para representar los electrones internos.
Relación entre el radio y la capacidad de ceder electrones
Sección titulada «Relación entre el radio y la capacidad de ceder electrones»Un mayor radio atómico implica que los electrones más externos están más lejos del núcleo, lo que resulta en una mayor capacidad de ceder electrones, ya que la atracción del núcleo sobre ellos es menor.
Practica con los siguientes ejercicios y con el Quizlet.
Radio atómico
Sección titulada «Radio atómico»Instrucciones: Ordena los siguientes elementos según sea el caso. Para esto necesitas una tabla periódica.
Ordena de mayor a menor radio atómico: P, C, Mg
Sección titulada «Ordena de mayor a menor radio atómico: P, C, Mg»Paso 1: El radio atómico aumenta al descender en un grupo y disminuye al moverse de izquierda a derecha en un período.
Paso 2: Localizar los elementos en la tabla periódica
- Mg (Magnesio): Grupo 2, Periodo 3
- P (Fósforo): Grupo 15, Periodo 3
- C (Carbono): Grupo 14, Periodo 2
Paso 3: Comparando los elementos en el mismo periodo (Mg y P), el Mg está más a la izquierda que el P, por lo que Mg tiene un radio atómico mayor que P. El C está en un periodo superior al Mg y P, y también más a la derecha que el Mg, por lo que tiene el radio atómico más pequeño de los tres.
Respuesta: Mg > P > C
Ordena de menor a mayor radio atómico: C, Si, Ge
Sección titulada «Ordena de menor a mayor radio atómico: C, Si, Ge»Paso 1: El radio atómico aumenta al descender en un grupo.
Paso 2: Localizar los elementos en la tabla periódica
- C (Carbono): Grupo 14, Periodo 2
- Si (Silicio): Grupo 14, Periodo 3
- Ge (Germanio): Grupo 14, Periodo 4
Paso 3: Como todos están en el mismo grupo, el radio atómico aumenta a medida que se desciende en el grupo.
Respuesta: C < Si < Ge
Ordena de mayor a menor radio atómico: Br, Al, K
Sección titulada «Ordena de mayor a menor radio atómico: Br, Al, K»Paso 1: El radio atómico aumenta al descender en un grupo y disminuye al moverse de izquierda a derecha en un período.
Paso 2: Localizar los elementos en la tabla periódica
- K (Potasio): Grupo 1, Periodo 4
- Al (Aluminio): Grupo 13, Periodo 3
- Br (Bromo): Grupo 17, Periodo 4
Paso 3: El K está en el Periodo 4 y es el más a la izquierda, por lo que tiene el radio atómico más grande. El Br también está en el Periodo 4 pero más a la derecha que el K, por lo que tiene un radio atómico menor que el K. El Al está en el Periodo 3 y más a la izquierda que el Br en su periodo, pero en un periodo inferior al K, por lo que su radio atómico es intermedio entre K y Br.
Respuesta: K > Br > Al
Ordena de menor a mayor radio atómico: Be, Sr, Ra
Sección titulada «Ordena de menor a mayor radio atómico: Be, Sr, Ra»Paso 1: El radio atómico aumenta al descender en un grupo.
Paso 2: Localizar los elementos en la tabla periódica
- Be (Berilio): Grupo 2, Periodo 2
- Sr (Estroncio): Grupo 2, Periodo 5
- Ra (Radio): Grupo 2, Periodo 7
Paso 3: Ordenar según la tendencia
Electronegatividad
Sección titulada «Electronegatividad»Ordena según se indique.
- De mayor a menor electronegatividad: Sodio (Na), Cloro (Cl), Silicio (Si). Respuesta: F, O, S
- De menor a mayor electronegatividad: Selenio (Se), Azufre (S), Oxígeno (O). Respuesta: Se, S, O
- De mayor a menor electronegatividad: Potasio (K), Aluminio (Al), Calcio (Ca). Respuesta: Ca, Al, K
- De menor a mayor electronegatividad: Indio (In), Boro (Bo), Aluminio (Al). Respuesta: In, Al, B